A dengue é uma doença infeciosa que acomete milhares de brasileiros e ainda preocupa autoridades de saúde pública. Nos primeiros dois meses deste ano, os casos de dengue tiveram aumento de 35,4% em comparação com o mesmo período do ano passado, segundo dados do Ministério da Saúde. Foram 30 óbitos e 128.379 casos.
Mesmo com pesquisas há décadas, ainda não temos uma vacina eficiente como vimos para a Covid-19. Somente um imunizante está disponível no Brasil, mas apenas no mercado privado e com restrições de uso (entenda mais abaixo).
Outra vacina aguarda a aprovação da Anvisa desde o ano passado e, além disso, o Instituto Butantan está desenvolvendo – com parceria internacional – um imunizante do tipo, há mais de 10 anos.
Entenda, abaixo, quais são as vacinas já conhecidas, os estudos e quais as perspectivas para o SUS:
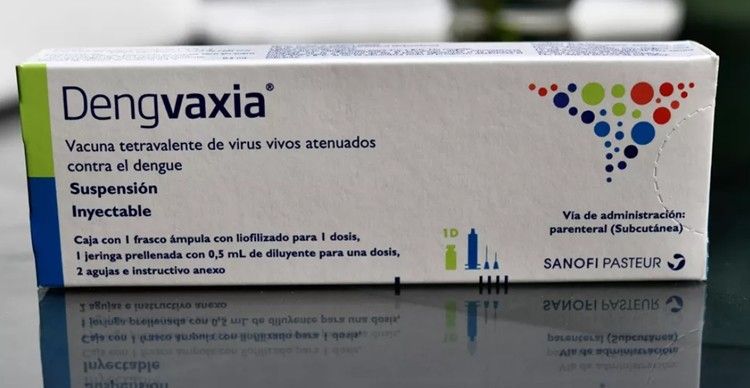
1.Dengvaxia, da Sanofi Pasteur
Atualmente, a única vacina contra a dengue disponível no Brasil é a Dengvaxia (a primeira que teve registro no mundo), fabricada pelo laboratório francês Sanofi Pasteur. O imunizante é vendido na rede privada na maior parte do Brasil e não está disponível no Programa Nacional de Imunizações, o PNI.
Segundo a fabricante, a vacina promove imunidade de longa duração para os quatro sorotipos da dengue, prevenindo aproximadamente 8 em cada 10 casos de dengue grave e com risco de hospitalização.
Os sorotipos são as diferentes linhagens de um patógeno, os organismos que causam doenças. No caso da dengue eles são chamados de arbovírus, ou seja, são normalmente transmitidos por mosquitos (o Aedes aegypti).
Quem pode tomar?
A Dengvaxia não é recomendada para quem nunca entrou em contato com o vírus da dengue. Essa é uma recomendação reforçada pela Anvisa e pela Organização Mundial de Saúde.
Isso ocorre porque estudos da própria fabricante indicaram que esses indivíduos soronegativos que tomaram a vacina apresentaram, em longo prazo, mais casos da forma grave da dengue, após uma infecção pela doença.
Assim, a vacina é indicada para indivíduos de 9 a 45 anos com infecção prévia por dengue e seu esquema de administração consiste em três doses, que devem ser intercaladas num intervalo de 6 meses.
Renato Kfouri, médico pediatra e diretor da Sociedade Brasileira de Imunizações (SBIm), explica que essa é uma vacina que mostrou um risco aumentado de complicações para as pessoas que não tiveram a doença antes de serem vacinadas.
A bula da Dengvaxia determina que seja realizado um teste laboratorial ou soroteste para descobrir se o futuro vacinado teve uma infecção prévia pela doença.
Para a professora Hillegonda Maria Novaes, que participou do grupo de trabalho da vacina da dengue que fez os estudos com as recomendações para a OMS, essa vacina desde o início foi considerada “problemática”.
“Condicionar uma vacina à realização de um teste anterior é muito complicado e muito caro, nenhuma vacina aprovada é assim. Um estudo de caso-controle realizado no Paraná chegou à conclusão que ela mostrou efetividade na prevenção da infecção e na evolução para casos graves para apenas um dos 4 sorotipos”, diz.
Atualmente, a farmacêutica, juntamente com a CTK Biotech, desenvolveu ainda um novo teste de diagnóstico rápido (TDR) para detectar infecções anteriores por dengue que já foi inclusive aprovado pela Anvisa.
Porém, como ressalta Alberto Chebabo, presidente da Sociedade Brasileira de Infectologia, esse novo teste é uma ferramenta que facilita a aplicação somente daqueles que desejam se vacinar com a vacina, e não campanhas de vacinação em massa.
“Para campanhas de vacinação populacional fica muito complicado. Eu acho muito difícil que essa vacina possa participar do PNI, por exemplo. Mas, individualmente, na clínica privada, ajuda sim”, pontua Chebabo.
Como a vacina está disponível?
No Brasil, o único estado que chegou a disponibilizar o imunizante da Sanofi foi o Paraná. A campanha de vacinação contra a dengue foi ofertada para a população em 30 cidades do estado, no período de agosto de 2016 a setembro de 2017.
No ano de 2018, a vacina foi ofertada apenas para as pessoas que já haviam recebido a vacina nos anos anteriores, ou seja, somente para conclusão dos esquemas vacinais.
O g1 procurou a secretaria de saúde do Paraná para saber se o estado ainda planejava campanhas de vacinação contra a dengue, mas, segundo resposta do órgão, depois da recomendação da Anvisa, a secretaria disse que “ficou inviável” a continuidade da campanha, “uma vez que seria necessário a testagem sorológica prévia à vacinação”.
Assim, atualmente, a Dengvaxia está disponível somente no mercado privado de vacinação.
Por que não foi incluída no PNI?
Para Carla Domingues, epidemiologista e ex-coordenadora do Programa Nacional de Imunizações (PNI), essa decisão do governo paranaense foi “precipitada”.
“Um programa de vacinação exitoso para enfrentar um problema de saúde pública como é o caso da dengue deve ser pensado nacionalmente e uma ação feita em apenas alguns municípios de um único estado não tem impacto na diminuição da carga da doença”, explica.
Na época, o Ministério da Saúde tinha se posicionado afirmando que não iria implantar a vacina até que houvesse mais dados para subsidiar a tomada de decisão.
“Portanto, a decisão do Ministério foi adequada, pois era necessário ter mais evidências para a inclusão da vacina no PNI”, acrescenta.
Domingues também aponta que, à época, tendo em vista que os dados de eficácia da vacina não eram elevados, era fundamental entender qual seria o comportamento da vacina após o seu uso na população, principalmente porque ela não apresentava eficácia para o tipo 2 da dengue.
O g1 também entrou em contato com o governo federal perguntando se há uma previsão de incorporação da Dengvaxia no PNI e quais os resultados do estudo de custo-efetividade realizado em 2018, mas não obteve resposta do Ministério da Saúde.
Em nota enviada ao g1, a Sanofi Pasteur informou que não há estudos clínicos sendo conduzidos pela empresa para a avaliar o uso da vacina em indivíduos sem infecção prévia por dengue.
“De acordo com o uso indicado em bula, bem como recomendações externas, a testagem e vacinação continua sendo a abordagem recomendada para o uso de Dengvaxia”, disse a fabricante.
2.TAK-003, da Takeda
Em abril do ano passado, a farmacêutica Takeda enviou à Anvisa a solicitação do registro de sua vacina tetravalente (que protege contra os quatro sorotipos) contra à dengue, a TAK-003.
Segundo a empresa, foi requerida prioridade na análise do dossiê enviado à agência regulatória, que apresenta os dados de eficácia e segurança da vacina.
“A estimativa do prazo de aprovação cabe à Anvisa, mas a companhia está comprometida a responder de forma ágil a todos os questionamentos que forem levantados”, afirmou a Takeda, em nota.
Segundo a Anvisa, o pedido de registro segue em análise. A agência solicitou ao laboratório a apresentações de informações necessárias para o seguimento do processo.
Quem poderá tomar?
Segundo a empresa, a proposta da vacina é ser indicada para prevenção da dengue em pessoas de 4 a 60 anos de idade. Portanto, não há distinção entre quem teve ou não a doença. Ela poderá ser aplicada em ambos os casos.
O infectologista Alberto Chebabo explica que, até o momento, os estudos que foram publicados sobre o imunizante da farmacêutica japonesa mostram que o problema que aconteceu com a vacina da Sanofi não ocorreu com a vacina da Takeda.
“O último segmento que está sendo avaliado pela vacina da Takeda é a faixa etária de 2 a 3 anos. Se eles realmente conseguirem mostrar que não houve, neste segmento, risco aumentado de doença grave na população não vacinada, não haveria necessidade de se fazer sorologia prévia. O que ajuda muito”, avalia Chebabo.
O estudo de fase 3, que analisou crianças e adolescentes de 4 a 16 anos, mostrou que a eficácia geral da vacina foi de 80,9%. Para os casos de hospitalizações, o índice foi ainda maior: 95,4% de eficácia. Apesar disso, segundo a pesquisa, a eficácia do imunizante variou de acordo com o sorotipo da dengue.
“A vacina da Takeda já concluiu seus estudos de fase 3. Já tem dados de até três anos de segmento desses indivíduos, com uma discrepância de uma eficácia maior para um tipo de dengue do que outro, mas que pode cumprir um papel importante no controle da doença”, analisa Kfouri.
3.Vacina da dengue do Butantan
O Instituto Butantan vem desenvolvendo uma vacina contra a dengue há mais de 10 anos, em parceria com o Instituto Nacional de Alergia e Doenças Infecciosas dos Estados Unidos (NIH, na sigla em inglês).
O estudo de fase 1 sobre o imunizante mostrou que ele induziu a geração de anticorpos (soroconversão) em 100% dos indivíduos que já tiveram dengue e em mais de 90% naqueles que nunca haviam tido contato com o vírus.
No teste clínico de fase 2, tanto a vacina liofilizada (em pó) desenvolvida pelo Instituto quanto a formulação original do NIH, induziram a produção de anticorpos e de células de defesa em pessoas com ou sem contato prévio com todos os sorotipos da dengue.
Quem poderá tomar?
Assim, a vacina, que também é tetravalente, deve proteger pessoas com e sem contato prévio com o vírus. Essa sua imunogenicidade, ou seja, a capacidade da vacina de gerar uma resposta imune, foi analisada durante um ano por meio de testes de neutralização do vírus e se manteve alta em todos os participantes.
A vacina está sendo produzida com os quatro tipos do vírus da dengue atenuados, ou seja, enfraquecidos. A expectativa é que uma dose seja suficiente, já que, segundo os estudos, a dose adicional não induziu diferenças significativas.
“Os estudos mostram uma eficácia importante e uma segurança em reduzir os eventos adversos graves pós vacina, que foi o problema da vacina da Sanofi”, destaca Chebabo.
De acordo com o Butantan, as reações mais comuns foram leves, como dor de cabeça, fadiga, erupção cutânea e mialgia (dor muscular).
“Esses estudos do Instituto ainda precisam evoluir. A gente precisa da fase 3 para ter essas respostas com certeza, mas já temos uma resposta imune importante”, acrescenta.
Segundo o Butantan, a pesquisa deve ser finalizada até 2024.
“Essa é uma vacina experimental. Ela tem uma tecnologia diferente de produção, mas os dados de segurança no curto prazo e sua resposta imune são bastante adequados”, salienta Renato Kfouri, da SBIm.
Os voluntários da pesquisa estão sendo avaliados por 5 anos. De acordo com o Instituto, esse período é importante para que seja garantida a segurança e imunogenicidade da vacina e envolve todos voluntários do estudo, independentemente de pessoas infectadas ou não pelo vírus dengue.
Após o término do estudo de fase III, os dados serão analisados por uma comissão independente e só então o resultado dessa análise será submetido à aprovação da Anvisa.
“Estamos tentando agilizar todas essas etapas para entregar a vacina o quanto antes”, disse o Butantan.